本解析は、SLEにより最も影響を受ける2つの器官での症状について検討しました(2-3)。Anifrolumabは、ファースト・イン・クラスの1型インターフェロン阻害剤です。
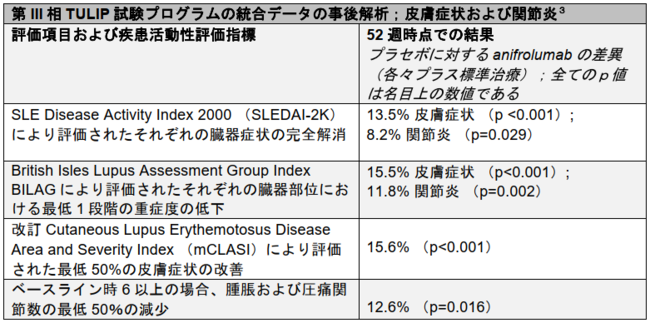
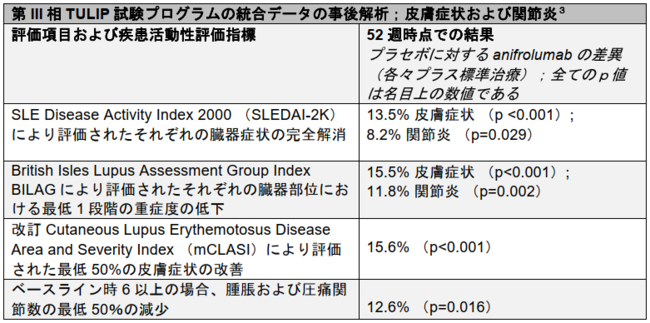
皮膚症状に関し、52週時点でのaifrolumab投与群とプラセボ投与群の奏効率の差はSLE Disease Activity Index(SLEDAI)で13%、British Isles Lupus Assessment Group Index (BILAG)で15.5%、および改訂Cutaneous Lupus Erythematosus Disease Area (mCLASI)で15.6%でした。関節炎に関し、奏効率の差は、SLEDAIで8.2%、 BILAGで11.8%、および関節の改善で12.6%でした(3)。
米国の関節炎および臨床免疫学研究プログラムのオクラホマメディカルリサーチ財団Joan Merrillは次のように述べています。「関節炎および皮膚症状はループスに最もよく見られる持続性の症状であり、多くの場合患者さんの生活に大きな影響を及ぼします。本解析のデータの強みは、皮膚症状と関節炎に関しては3つの異なる評価方法で検討したが、一貫してanifrolumabが有効性を示したことが判明したことです。改善を複合的にとらえたことで、anifrolumabが患者さんにとって重要な選択肢となり得るかもしれないとの確信が高まりました」。
バイオ医薬品研究開発部門担当エグゼクティブバイスプレジデントであるMene Pangalosは次のように述べています。「EULARで発表されたデータは、anifrolumabがこの消耗性の疾患に対する大きなアンメットニーズを満たす可能性を示す説得力のある臨床プロファイルを示しています。全世界的には10年以上SLEに対する新薬は承認されていない状況で、当社は、1日も早く、この新たな治療薬を提供できるよう取り組んでいます」。
TULIP-1試験およびTULIP-2試験においてanifrolumabに関する最も高頻度に報告された有害事象としては、上気道感染症、気管支炎、点滴関連事象および帯状疱疹が挙げられます(4-5)。
アストラゼネカによるSLEを適応とするanifrolumabの承認申請は、米国、EUおよび日本の規制当局により現在審査中です。Anifrolumabが現在承認されている国はありません。
以上
*****
全身性エリテマトーデス(SLE)について
SLEは、免疫系が自身の正常な細胞や組織を攻撃してしまう自己免疫疾患です(6)。慢性的であり、さまざまな臨床症状を伴う複雑な疾患であるため、多くの臓器に影響を及ぼし、痛み、発疹、倦怠感、関節の腫れ、発熱など幅広い症状の原因となります(7)。SLE患者さんの50%以上は、症状を増悪し死亡リスクを上昇させる、本疾患あるいは既存の治療薬による恒久的な臓器損傷を引き起こします(8-9)。世界中で少なくとも500万人がある種のループスに罹患しています(10)。しかしながら、この10年間でSLE治療薬として承認を受けた新薬はありません(11)。
SLEを対象としたTULIP-1試験とTULIP-2試験について
TULIP(Treatment of Uncontrolled Lupus via the Interferon Pathway)は極めて重要なプログラムで、TULIP-1試験および TULIP-2試験という2つの第III相プログラムから成り立ち、anifrolumabの有効性と安全性をプラセボとの比較で評価しました。
両試験とも標準治療を受けている中等症から重症の自己抗体陽性SLE患者さんを対象とする無作為化二重盲検プラセボ対照試験です(4-5)。標準治療は経口ステロイド(OCS)、抗マラリア薬および免疫抑制薬(メトトレキサート、アザチオプリン、MMFとして知られるミコフェノール酸モフェチル)により構成されました。
TULIP-2試験では、標準治療に加えてanifrolumab又はプラセボの投与を行い、anifrolumabはプラセボに対し複数の有効性評価項目において優位性を示しました。本試験では条件に該当する362例の患者さんを無作為化し(1:1)、300mgのanifrolumab投与群とプラセボ投与群に分けて4週間ごとに固定用量で静脈投与を行いました。TULIP-2試験はBILAG-Based Composite Lupus Assessment(BICLA)に基いて疾患活動性の低下を測定することにより、anifrolumabの有効性を評価しました(4)。TULIP-1試験では、条件に該当する457例の患者さんを無作為化し(1:2:2)、標準治療に加えて150mgおよび300mgのanifrolumab投与群とプラセボ投与群に分けて4週間ごとに固定用量で静脈投与を行いました。本試験は、SLE Responder Index 4(SRI4)複合評価指標による主要評価項目を達成しませんでした(5)。
SLEにおいては、主要第Ⅲ相TULIP プログラムに加えて、anifrolumabの長期第III相延長試験が継続して評価されています(12)。皮下投与を用いたSLEに対するanifrolumabの第II相試験は完了しました(13)。加えて、アストラゼネカはループス腎炎、皮膚エリテマトーデスおよび筋炎を含む1型インターフェロンが重要な役割を担う様々な疾患に対するanifrolumabの可能性を探求しています(14)。
EULARで発表された本解析には臓器部位に応じた3つの異なる疾患活動性評価指標が含まれています(3)。
Anifrolumabについて
Anifrolumabは、Ⅰ型インターフェロン受容体のサブユニット1に結合する完全ヒト型モノクローナル抗体であり、1型インターフェロンの活動を阻害します(15)。IFN-alpha、IFN-beta、IFN-betaおよびIFN-kappaなどの1型インターフェロンはループスに示唆されている炎症反応経路の調節に関与するサイトカインです(16-17)。ループスの成人患者さんの大多数に、疾患活動性および重症度との相関性が知られているⅠ型インターフェロン遺伝子発現の増加が見られます(16-18)。
アストラゼネカは、メダレックス社と2004年に締結した独占権および提携契約により、anifrolumabの全世界を対象とする権利を有しています。なお、メダレックス社は2009年にブリストル・マイヤーズスクイブ社に買収されています。
アストラゼネカにおける呼吸器および免疫領域について
バイオ医薬品部門の一部である呼吸器・免疫領域はアストラゼネカが注力する3つの治療領域のひとつで、当社にとって重要な今後の成長の原動力です。
アストラゼネカは呼吸器疾患治療における確固たるリーダーであり、吸入薬および生物学的製剤を2019年5,300万人を超える患者さんにお届けしました。50年の歴史を基盤として、アストラゼネカは、すべての重症度における予防可能な喘息発作をなくし、生物学的製剤を中心とした早期治療により、喘息およびCOPD治療を革新的に向上させ、COPDを死因の上位3位から除くことを目指しています。また、当社の呼吸器領域における初期研究では、疾患や神経機能不全における免疫機構、肺損傷および異常細胞修復プロセス等の新たなサイエンスに焦点を当てています。
アストラゼネカは、呼吸器疾患と免疫疾患に共通する経路と基礎疾患ドライバーを足掛かりに、慢性肺疾患から自己免疫疾患領域まで網羅する研究に注力していきます。また、リウマチ性疾患(全身性エリテマトーデスを含む)、皮膚疾患、消化器疾患、全身性好酸球性疾患をはじめ、複数疾患につながる可能性がある5つの中期~後期フランチャイズに焦点を当て、自己免疫疾患領域におけるプレゼンスを高めています。アストラゼネカは、呼吸器・免疫疾患領域において、世界中の多くの患者さんのために疾患修飾および継続的な寛解を達成することを目指しています。
アストラゼネカについて
アストラゼネカは、サイエンス志向のグローバルなバイオ・医薬品企業であり、主にオンコロジー、循環器・腎・代謝疾患、および呼吸器・免疫疾患の3つの重点領域において、医療用医薬品の創薬、開発、製造およびマーケティング・営業活動に従事しています。英国ケンブリッジを本拠地として、当社は100カ国以上で事業を展開しており、その革新的な医薬品は世界中で多くの患者さんに使用されています。詳細についてはhttp://www.astrazeneca.comまたは、ツイッター@AstraZeneca(英語のみ)をフォローしてご覧ください。
References
1. Merrill JT, et al. Anifrolumab Effects on Rash and Arthritis in Patients With SLE and Impact of Interferon Signal in Pooled Data From Phase 3 Trials. Oral presentation at: the 2021 European Alliance of Associations for Rheumatology (EULAR) European Congress of Rheumatology; 3 June 2021; virtual. Abstract ID: 1471.
2. Werth V, Furie R, Morand E, et al. Early and Sustained Reduction in Severity of Skin Disease With Anifrolumab Treatment in Patients With Active SLE Measured by the Cutaneous Lupus Erythematosus Disease Area and Severity Index (CLASI): Pooled Data From 2 Phase 3 Studies Oral presentation at: American College of Rheumatology (ACR) Convergence 2020; 5-9 November 2020; virtual. Abstract ID: 0985.
3. Merrill JT, et al. Anifrolumab effects on rash and arthritis: impact of the type I interferon gene signature in the phase IIb MUSE study in patients with systemic lupus erythematosus. Lupus Sci Med. 2018;5(1):e000284. Accessed June 2021.
4. Morand E, et al. Trial of Anifrolumab in Active Systemic Lupus Erythematosus. N Engl J Med. 2020;382(3):211-221. Accessed June 2021.
5. Furie R, et al. Type I interferon inhibitor anifrolumab in active systemic lupus erythematosus (TULIP-1): a randomised, controlled, phase 3 trial. Lancet Rheumatol. 2019;1(4):e208-e219. Accessed June 2021.
6. The Lupus Foundation of America. What is Lupus? Available online. Accessed June 2021.
7. American College of Rheumatology. Guidelines for referral and management of systemic lupus erythematosus in adults. Arthritis & Rheumatology. 1999; 42:1785-1796. Accessed June 2021.
8. Bruce IN, et al. Factors associated with damage accrual in patients with systemic lupus erythematosus: results from the systemic lupus international collaborating Clinics (SLICC) inception cohort. Ann Rheum Dis. 2015;74:1706-1713. Accessed June 2021.
9. Segura BT, et al. Damage accrual and mortality over long-term follow-up in 300 patients with systemic lupus erythematosus in a multi-ethnic British cohort. Rheumatol. 2020;59(3):524-533. Accessed June 2021.
10. The Lupus Foundation of America. Lupus facts and statistics. Available online. Accessed June 2021.
11. Mahieu MA, et al. A critical review of clinical trials in systemic lupus erythematosus. Lupus. 2016;25(10):1122-1140. Accessed June 2021.
12. ClinicalTrials.gov. Long Term Safety of Anifrolumab in Adult Subjects With Active Systemic Lupus Erythematosus (TULIP SLE LTE). NCT Identifier: NCT02794285. Accessed June 2021.
13. Chatham WW, et al. Long-Term Safety and Efficacy of Anifrolumab in Adults With Systemic Lupus Erythematosus: Results of a Phase II Open-Label Extension Study. Arthritis Rheumatol. 2021;73(5):816-825. Accessed June 2021.
14. Crow MK, et al. Report of the inaugural Interferon Research Summit: interferon in inflammatory diseases. Lupus Sci Med. 2018;5(1):e000276. Accessed June 2021.
15. Furie R, et al. Anifrolumab, an Anti–Interferon‐α Receptor Monoclonal Antibody, in Moderate‐to‐Severe Systemic Lupus Erythematosus. Arthritis Rheumatol. 2017;69(2):376-386. Accessed June 2021.
16. Lauwerys BR, et al. Type I interferon blockade in systemic lupus erythematosus: where do we stand?. Rheumatol. 2013;53(8):1369-1376. Accessed June 2021.
17. Sarkar MK, et al. Photosensitivity and type I IFN responses in cutaneous lupus are driven by epidermal-derived interferon kappa. Ann Rheum Dis. 2018;77:1653-1664. Accessed June 2021.
18. Crow MK. Type I Interferon in the Pathogenesis of Lupus. J Immunol. 2014;192(12):5459-5468. Accessed June 2021.