New England Journal of Medicineに掲載されたNAVIGATOR試験データ、2021年米国胸部疾患学会国際会議 (ATS)で発表されたtezepelumab臨床プログラムの最新データ
Tezepelumab、NAVIGATOR試験の炎症バイオマーカー高値のサブグループにおいて増悪を77%抑制
Tezepelumab、入院を要する増悪を85%抑制
主要第III相NAVIGATOR試験の詳細結果により、ファースト・イン・クラスの治療薬候補であるアストラゼネカとアムジェンのtezepelumabが、標準治療(SoC)への追加療法において、プラセボとの比較で、広範な重症喘息患者集団で全ての主要および副次的評価項目において優位性が実証されました(1)。
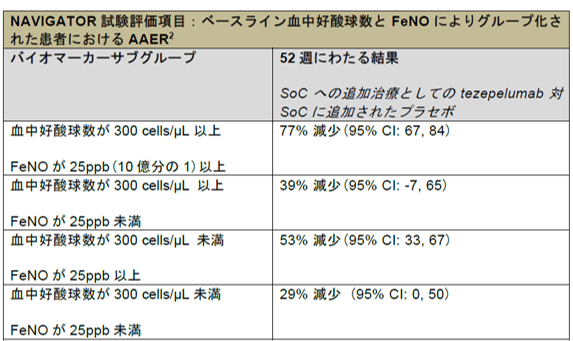
NAVIGATOR試験の事前に規定された探索的解析のひとつにおいて、血中好酸球数値および呼気中一酸化窒素濃度 (FeNO) のレベルに基づき、4つの患者サブグループにおいてプラセボと比較して、tezepelumabのSoCへの追加治療群で52週にわたり年間喘息増悪率 (AAER)の減少がみられました(1,2)。血中好酸球数とFeNOは臨床医が治療選択をするために使用する2つの重要な炎症性バイオマーカーであり、血中好酸球数は300 cells/µL以上または300 cells/µL未満、FeNOは25ppb以上または25ppb未満と定義されました(1,2)。
ベースライン時の血中好酸球数 (300 cells/µL 以上) およびFeNOの値 (25 ppb以上) が高値の患者さんにおいて、プラセボと比較し、tezepelumabは臨床的に有意義な77%のAAER減少を達成しました(1,2)。
別の探索的解析において、tezepelumabはSoCへの追加療法として、プラセボと比較し、入院を要する増悪を52週にわたり80%の減少を示しました(1,3)。
また、tezepelumabは、プラセボに対し、主な副次的評価項目である呼吸機能、喘息コントロール、健康に関連するQOLに関しても統計学的に有意な改善を示しました(1)。これらの改善はtezepelumab治療群において治療開始後わずか2週目または初回の評価ポイントでみられ、治療期間を通して持続しました。
これらの結果は、2021年2月に発表されたNAVIGATOR試験のデータ(患者集団全体において52週にわたる統計学的に有意かつ臨床的に有意義な(4) AAERの減少を示した)を更に補強するものです。プラセボと比較し、AAERの臨床的に有意義な減少は、血中好酸球数、アレルギーの状態またはFeNOの値に問わず、tezepelumab治療群においてみられました(1)。
英国ロンドンのロイヤルブロンプトン病院肺部門の部長であり第III相NAVIGATOR試験の治験総括医師であるAndrew Menzies-Gow教授は次のように述べています。「重症喘息の管理は、多くの場合、複数の炎症経路が患者の疾患の複雑性に寄与しているため困難です。この最新の結果は、炎症のタイプにかかわらず広範な集団の重症喘息患者さんに対する治療を変革するtezepelumabの可能性を裏付けるものです」。
アストラゼネカのバイオ医薬品研究開発部門担当エグゼクティブバイスプレジデントであるMene Pangalosは、次のように述べています。「重症喘息患者さんの喘息関連の入院リスクは2倍であるため、NAVIGATOR試験でみられた入院の減少は重要です。これらの結果はtezepelumabが、広範な重症喘息患者さんを治療し、本疾患による医療システムへの負担を低減する可能性があることを示しています」。
これらの結果はNew England Journal of Medicineに掲載されましたが、今週、2021年米国胸部疾患学会国際会議(ATS)で発表されます。
第III相SOURCE試験と第II相CASCADE試験の主要解析を含む、tezepelumabのPATHFINDER臨床試験プログラムのさらなる結果も今週ATSで発表されます。
すでに公表したように、第III相SOURCE試験は、プラセボに対しtezepelumabは喘息コントロールを失うことなく経口ステロイド (OCS)の1日用量を統計学的に有意に減量させるという主要評価項目を達成しませんでした(5)。発表予定のデータは、90%以上のOCSの減量を達成した症例数は、tezepelumab治療群において数値的により高く54.1%であった一方、プラセボ群では46.1%であったことを示しています(6)。SOURCE試験において、tezepelumab治療群は増悪、1秒量および患者報告アウトカムでプラセボに対し改善を示しましたが(6)、これは、第II相PATHWAY試験および第III相NAVIGATOR試験のOCS依存症例の統合事後解析により示された改善と一致しています(7,8)。OCSによる維持療法を受けている患者さんの喘息コントロールを維持しながらOCSの使用を減少するtezepelumabの能力を評価する新たな試験が計画中です。新たな試験は主要評価項目の結果に寄与した可能性のあるSOURCE試験のデザインの特徴に対処することを目的とします。
ATSでは同時に、第II相CASCADE試験の結果から、中等症から重症の広範な喘息患者さんにおいてtezepelumabがプラセボに対し、ベースラインの血中好酸球数、FeNOのレベル、およびアレルギーの状態別(9)に層別化されたサブグループ全体で、気道組織中の好酸球数を減少させたことを示したことが発表されます。重要な点は、好酸球性気道炎症の有無にかかわらず、tezepelumabは、プラセボに比べ、喘息の主要な特徴である気道過敏性の低下(9)と関連していたことです。
NAVIGATOR(1)試験において、有害事象はTezepelumab投与群とプラセボ群でそれぞれ77.1%、80.8%に発現しました。また重篤な有害事象はそれぞれ9.8%、13.7%に発現しました。CASCADE試験においては、有害事象はTezepelumab投与群とプラセボ群でそれぞれ89.8%、89.5%に発現しました(9)。Tezepelumabに関連する最も高い頻度で報告された有害事象は、NAVIGATOR試験では、鼻咽頭炎、上気道感染症、頭痛および喘息(1)、SOURCE試験では、鼻咽頭炎、上気道感染症、喘息および細菌性気管支炎(6)、CASCADE試験では、鼻咽頭炎、処置後 (気管支鏡)の合併症および頭痛でした(9)。
※Tezepelumabは本邦未承認です。
*****
重症喘息について
喘息は世界で推定3億3,900万人の人々に影響を与えている多様性を有する疾患です(12,13)。喘息患者さんの約10%は重症喘息に罹患しています(13,14)。吸入の喘息長期管理薬および現在使用可能な生物学的製剤を使用しているにも関わらず、多くの患者さんはコントロール不良の状態に留まっています(3-15)。重症喘息はその複雑性により、多くの患者さんにおいて炎症の病態が明確ではなく、複数の炎症機序を有しており、既存の生物学的製剤に適さない場合や、良好に反応しない可能性があります(14-17)。
コントロール不良の重症喘息は消耗性疾患で、患者さんは頻回な増悪を経験し、著しい呼吸機能の低下、生活の質の低下を余儀なくされます(13,14,18)。コントロール不良の重症喘息患者さんの死亡リスクは高く、これらの患者さんでは喘息関連の入院頻度が2倍高いとされています(19-21)。さらに、疾患による社会経済的な負担も大きく、経済的負担は喘息関連費用の約50%にあたるとも言われています(21)。
NAVIGATORおよびPATHFINDER臨床試験プログラムについて
第IIb相PATHWAY試験を更に拡充し、第III相PATHFINDERプログラムにはNAVIGATOR試験(1,23)およびSOURCE試験.(6,24)の2つの試験が含まれました。本プログラムは新たに計画中の長期安全性試験であるDESTINATION試験(25)および実施中のメカニズム試験であるCASCADE試験(9,26)が含まれます。
NAVIGATOR試験は、OCS 併用の有無を問わず、中用量もしくは高用量の吸入ステロイド(ICS)に、少なくとももうひとつの喘息コントロール薬を加えた治療を受けていた成人(18歳から80歳) および青年期 (12歳から17歳)のコントロール不良の重症喘息患者さんを対象とする第III相無作為化二重盲検プラセボ対照試験です。本試験では、血中好酸球数が高い被験者(300 cells/µL 以上)と低い被験者(300 cells/µL 未満)がほぼ均等に割り付け登録されました。本試験は、5週から6週のスクリーニング期間、52週の治療期間および12週の治療後の追跡期間により構成されました。試験期間中、全被験者の処方されていた喘息長期管理薬の変更はありませんでした(1)。
主要有効性評価項目は52週の治療期間でのAAERでした。主な副次的評価項目には呼吸機能、喘息コントロールおよび健康に関連する生活の質に対するtezepelumabの効果が含まれていました(1)。
事前に規定された解析の一環として、52週間にわたるAAERは、ベースラインの血中好酸球数、FeNOのレベル、血清特異的免疫グロブリンE(IgE)のレベル(通年性アレルゲン感受性陽性または陰性)によって層別化された患者でも評価されました1。これらは、臨床医が治療選択をするために使用する炎症性バイオマーカーであり、血液(好酸球/ IgE)と呼気(FeNO)を分析する検査が含まれます。
CI: Confidence interval 信頼性区間
NAVIGATOR試験は、血中好酸球数を問わず、TSLPを標的とすることで重症喘息に対する効果を示した最初の第III相試験です(1)。Tezepelumabは好酸球性フェノタイプを持たない重症喘息患者さんの治療薬として2018年9月に、米国食品医薬品局により画期的治療薬指定US Food and Drug Administration Breakthrough Therapy Designationが付与されています。
SOURCE試験は、第III相多施設共同無作為化二重盲検並行群間プラセボ対照試験で、ICSと長時間作用性β2刺激薬 (LABA) による継続治療に、OCS維持療法を必要とする成人重症喘息患者さんを対象とする48週間の試験です。主要評価項目は、喘息コントロールを維持した状況下での、OCSの1日用量のベースライン時からの減少率です(24)。
CASCADE試験は、第II相多施設共同無作為化二重盲検プラセボ対照並行群間メカニズム試験で、コントロール不良の中等症から重症喘息を有する18歳から75歳の成人を対象としています。主要評価項目は、気管支粘膜生検による気道粘膜下炎症性細胞 (好酸球、好中球、T細胞および肥満細胞)のベースラインから治療完了までの変化です(9)。
NAVIGATORおよびSOURCE試験の被験者は長期安全性および有効性を評価する第III相延長試験であるDESTINATION試験への継続的な参加が可能とされました(25)。
Tezepelumabについて
TSLPは複数の炎症カスケードの上流に位置し重症喘息に伴うアレルギー性、好酸球性または他のタイプの気道炎症の誘導および持続に不可欠な主要な上皮サイトカインであり、tezepelumabはTSLPの作用を阻害するファースト・イン・クラスのヒト化モノクローナル抗体製剤の候補として、アムジェンと提携しアストラゼネカにより開発中です(7,2)。TSLPは、アレルギー誘発物質、ウイルスおよび他の浮遊微小粒子を含む喘息増悪を引き起こす複数の誘発物質に反応して放出されます7,27。TSLPの発現は喘息患者さんの気道中で増加し、喘息の重症度と相関しています(7,28)。TSLP阻害により免疫細胞からの炎症性サイトカインの放出が抑制される可能性があり、その結果、喘息増悪が予防され喘息コントロールが改善されると考えられています(7,28)。Tezepelumabは炎症カスケードの上流に対して作用することで、炎症のタイプに関わらず、広範な重症喘息患者さんを治療できる可能性を有しています(7,28)。
アストラゼネカとアムジェンの提携について
2020年に入り、アムジェンとアストラゼネカはtezepelumabに関する2012年の提携契約を更新しました。これを受け、アストラゼネカによるアムジェンに対する1桁台半ばのロイヤリティの支払い後、両社は引き続き費用と利益を折半します。アストラゼネカは引き続き開発を主導し、アムジェンは引き続き製造を主導します。本提携のすべての側面は合同管理機関の監視下にあります。北米における契約のもと、アムジェンとアストラゼネカは共同でtezepelumabの商業化を実施します。アムジェンは米国での売上を計上し、アストラゼネカはカナダでの売上を計上します。米国におけるtezepelumabの総利益のアストラゼネカの持ち分は提携収入として認識されます。米国とカナダ以外の全ての国においては、アストラゼネカが単独でtezepelumabを商業化します。アストラゼネカは米国以外での全売上を製品売上として計上し、総利益のアムジェンの持ち分を売上原価として認識します。
アストラゼネカにおける呼吸器および免疫疾患領域について
呼吸器・免疫疾患はアストラゼネカが注力する3つの疾患領域のひとつで、当社にとって重要な今後の成長の原動力です。
呼吸器疾患はアストラゼネカの注力疾患領域のひとつで、吸入薬および生物学的製剤を2019年5,300万人を超える患者さんにお届けしました。50年の歴史を基盤として、アストラゼネカは吸入薬および生物学的製剤による呼吸器疾患治療の確固たるリーダーを築きました。アストラゼネカは、すべての重症度における予防可能な喘息発作をなくし、生物学的製剤を中心とした早期治療により、喘息およびCOPD治療を革新的に向上させ、COPDを死因の3位から除くことを目指しています。また、当社の呼吸器領域における初期研究では、疾患や神経機能不全における免疫機構、肺損傷および異常細胞修復プロセス等の新たなサイエンスに焦点を当てています。
アストラゼネカは、呼吸器疾患と免疫疾患に共通する経路と基礎疾患ドライバーを足掛かりに、慢性肺疾患から自己免疫疾患領域まで網羅する研究に注力していきます。また、リウマチ性疾患 (全身性エリテマトーデスを含む)、皮膚疾患、消化器疾患、全身性好酸球性疾患をはじめ、複数疾患につながる可能性がある5つの中期~後期フランチャイズに焦点を当て、自己免疫疾患領域におけるプレゼンスを高めています。アストラゼネカは、自己免疫疾患領域において、標的とする自己免疫に起因する疾患の疾患コントロールおよび究極的には臨床的な寛解を達成することを目指しています。
アストラゼネカについて
アストラゼネカは、サイエンス志向のグローバルなバイオ・医薬品企業であり、主にオンコロジー、循環器・腎・代謝疾患、および呼吸器・免疫疾患の3つの重点領域において、医療用医薬品の創薬、開発、製造およびマーケティング・営業活動に従事しています。英国ケンブリッジを本拠地として、当社は100カ国以上で事業を展開しており、その革新的な医薬品は世界中で多くの患者さんに使用されています。詳細についてはhttp://www.astrazeneca.comまたは、ツイッター@AstraZeneca(英語のみ)をフォローしてご覧ください。