本資料はアストラゼネカ英国本社が2021年1月29日に発信したプレスリリースを日本語に翻訳し、みなさまのご参考に提供するものです。本資料の正式言語は英語であり、その内容・解釈については英語が優先します。
アストラゼネカ(本社:英国ケンブリッジ、最高経営責任者(CEO):パスカル・ソリオ[Pascal Soriot])は、第Ⅲ相ADAURA試験の探索的解析の良好な結果から、アストラゼネカのタグリッソ®(一般名:オシメルチニブ、以下、タグリッソ)が、上皮成長因子受容体遺伝子変異陽性(EGFRm)非小細胞肺がん(NSCLC)患者さんにおいて、術後補助化学療法歴の有無、また疾患のステージにかかわらず、無病生存期間(DFS)を延長することが示されたと発表しました。これは、昨年( https://www.astrazeneca.co.jp/content/az-jp/media/press-releases1/2020/2020060401.html )発表された術後補助療法におけるタグリッソの主要評価項目であるDFSの顕著な延長という結果をさらに支持するものです。本試験の結果は、国際肺癌学会(IASLC)が主催する2020年世界肺癌学会(WCLC)(2021年1月開催)で発表され、プレス・プログラムに取り上げられました。
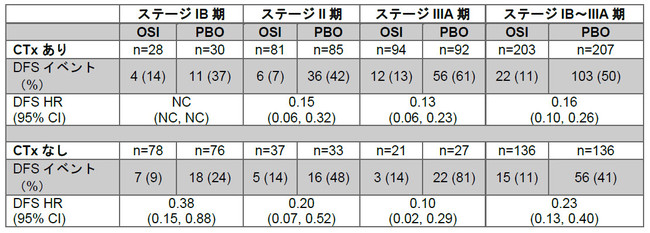
全症例を対象としたこの探索的解析において、タグリッソによる術後補助療法は、術後補助化学療法歴のある患者さんでは再発または死亡リスクを84%減少させ(ハザード比:0.16、95%信頼区間:0.10 – 0.26に基づく)、術後補助化学療法歴のない患者さんでは77%減少させました(ハザード比:0.23、95%信頼区間:0.13 – 0.40)。なおDFSの延長の有用性は各ステージで同程度でした。
さらに、ADAURA試験で実施された患者報告アウトカムに関する探索的事後解析では、タグリッソの投与を受けた患者さんの生活の質は維持されており、タグリッソ投与群とプラセボ投与群とでは身体的または精神的健康度に関して臨床的に意義のある差はなかったことが示されました。
第Ⅲ相ADAURA試験の治験責任医師であり、Guangdong Provincial People’s Hospital and Academy of Medical Sciences(中国・広州)の肺がん研究所の教授でアメリカ外科学会正会員(FACS)でもあるYi-Long Wu医学博士は次のように述べています。「ADAURA試験における患者さんの無病生存期間の延長という素晴らしい結果から、EGFRm NSCLCの術後補助療法において、タグリッソは先駆的な治療を担う役割がすでに支持されています。今回の報告で、無病生存期間の延長というベネフィットが、術後補助化学療法歴の有無および疾患のステージにかかわらず一貫していることを示しており、タグリッソがこの疾患の治療にいかに重要な役割を果たすかということがわかります」。
アストラゼネカのエグゼクティブバイスプレジデント兼オンコロジービジネスユニット責任者であるDave Fredricksonは次のように述べています。「これらの新規データは、タグリッソが術後補助化学療法歴の有無にかかわらず、患者さんの生活の質を維持しながら肺がんの再発を抑制できるといった変革的なベネフィットをもたらすことを示しています。タグリッソの術後補助療法として、昨年末の米国での承認を受け、この新たな標準治療を早期肺がん患者さんに早くお届けできるよう、各国の規制当局と協力してまいります」。
術後補助化学療法(CTx)の有無によるDFSの探索的解析
OSI:タグリッソ、PBO:プラセボ
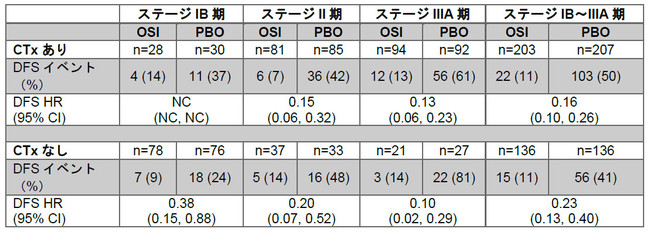
第Ⅲ相ADAURA試験では、術後補助化学療法歴を有する患者さんの割合を各群60%として両群間でバランスを取られていました。過去の試験および臨床診療で観察される患者集団と一致して、若年(70歳未満)およびより進行したステージの患者さんにおいて、術後補助化学療法を受けている割合が高いことが示されました(1,2)。化学療法の治療歴については、患者さんのパフォーマンスステータスによる相違は認められませんでした。
タグリッソの安全性と忍容性は、転移性EGFRmのNSCLC患者さんを対象にしたこれまでの試験と一致していました。治験担当医師による評価であらゆる原因によるグレード3以上となる有害事象の発生率は、タグリッソ投与群で20%、プラセボ投与群で13%でした。
2020年9月にThe New England Journal of Medicine( https://www.nejm.org/doi/full/10.1056/NEJMoa2027071 )誌で発表されたADAURA試験の主要な結果では、タグリッソによる術後補助療法は、ステージII期およびIIIA期のEGFRmのNSCLC患者さんにおいて、疾患の再発または死亡のリスクを83%低下させました(ハザード比:0.17、95%信頼区間:0.12 – 0.23、p<0.0001)。また、事前に規定した探索的解析で示されたように、中枢神経系(CNS)においてもプラセボと比較してDFSで臨床的に意義のある改善が認められました。
WCLCで発表されたタグリッソに関するその他の主な内容
WCLCではADAURA試験の解析に加えて、早期あるいは局所進行性または転移性肺がんの治療やその他の薬剤との併用療法に関してプレゼンテーションやポスターセッションがありました。
- 第Ⅰ相ODIN BM試験の結果は、これまでの臨床試験で報告されている、中枢神経系転移を有する患者さんにおけるタグリッソの有効性および均一な脳透過性を裏付けています。本試験では、PETスキャンで検出可能なタグリッソ静注剤のマイクロドーズを使用しました。これにより、EGFRmのNSCLC患者さん4例の健康な組織とCNS転移病変の両方において、タグリッソの脳への迅速かつ広範な曝露が示されました。加えて、タグリッソ3~4週間連日経口投与後に、患者さんのCNS転移病変が著明に減少したことを示す結果も得られました。
- 第Ⅰb相TATTON試験の2つの拡大コホートからの最終結果は、タグリッソと間葉上皮転換(c-MET)因子受容体チロシンキナーゼの選択的阻害薬であるサボリチニブの併用療法が、前回のEGFR-チロシンキナーゼ阻害薬(TKI)の投与後に進行したNSCLC患者さんにおいて、MET耐性を克服する可能性を裏付けています。タグリッソおよびサボリチニブの併用療法の安全性プロファイルは、これまでの報告と一致していました。この併用療法については、現在進行中の第Ⅱ相SAVANNAH試験およびORCHARD試験でも検討中です。
- タグリッソ単剤の投与中または投与後に進行が認められた、局所進行性または転移性EGFRmのNSCLC患者さんを対象とした、タグリッソとpatritumab deruxtecan(U3-1402)との併用療法を検討する第Ⅰ相探索的試験の試験デザイン(3)
- 切除可能なステージII~IIIB期のEGFRm NSCLC患者さんを対象に、術前補助療法におけるタグリッソ単剤または標準療法である白金製剤ベースの化学療法との併用を標準化学療法単独と比較検討する第Ⅲ相NeoADAURA試験の試験デザイン。この治験の被験者募集は継続中です。
タグリッソは、第Ⅲ相ADAURA試験の結果に基づいて、根治的腫瘍切除後の早期ステージのEGFRmのNSCLC成人患者さんに対する術後補助療法の治療薬として2020年12月に米国で承認されました。この適応症に対するタグリッソの優先審査が中国で行われており、欧州においても規制当局による審査が行われています。また、その他各国で承認申請に向けた議論が進行中です。またタグリッソは、局所進行または転移性EGFRm NSCLCの一次治療、および局所進行または転移性EGFR T790M変異陽性NSCLCの治療薬として、米国、日本、中国、欧州、および世界中の多くの国々で承認されています。
※EGFRm NSCLCの術前補助療法・術後補助療法に対するタグリッソの適応は、本邦では未承認です。
※サボリチニブは本邦では未承認です。
以上
*****
肺がんについて
肺がんは、男女共にがんによる死因の第1位であり、すべてのがんによる死亡の約5分の1を占めています(4)。肺がんは非小細胞肺がん(NSCLC)と小細胞肺がん(SCLC)に大きく分けられ、肺がん患者さんの80~85%がNSCLCと診断されます(5)。NSCLCの患者さんの大多数は進行がんで診断され、切除可能と診断されるのは全体の約25~30%です(6-8)。また早期の肺がんは、肺がんとは無関係に撮像された画像で診断されることがほとんどです(9-10)。切除可能ながん患者さんの多くが、手術(腫瘍の完全切除)および術後補助療法としての化学療法を受けても再発します(11)。欧米ではおよそ10~15%、アジアでは30~40%のNSCLC患者さんがEGFR遺伝子変異を有しています(12-14)。これらの患者さんはがん細胞の成長を促す細胞シグナル伝達経路を阻害するEGFRチロシンキナーゼ阻害剤(TKI)治療への感受性が高くなります(15)。
ADAURAについて
ADAURA試験は、腫瘍の完全切除および術後補助療法として(術後補助化学療法を伴う症例を含む)病期IB期、II期、IIIA期のEGFRmのNSCLC患者さん682例を対象に、タグリッソの術後補助療法に対する無作為化二重盲検プラセボ対照国際共同第Ⅲ相試験です。患者さんはタグリッソ80mg錠1日1回経口投与で3年間または再発するまで治療を受けました。なお、本試験は米国、欧州、南米、アジア、中東の20ヵ国以上、200を超える施設で実施されました。主要評価項目は病期II期およびIIIA期の患者さんにおけるDFSであり、重要な副次評価項目は病期IB期、II期およびIIIA期の患者さんにおけるDFSです。データ解析は当初2022年に予定されていましたが、2020年4月に独立データモニタリング委員会よりタグリッソが顕著な有効性を示したとして、ADAURA試験の非盲検化を予定より2年早める勧告を受けました。なお、被験者は試験を継続中であり、現在も本試験の盲検は維持されています。本試験では全生存期間の評価を引き続き行います。
タグリッソについて
タグリッソ(一般名:オシメルチニブ)は第3世代不可逆的EGFR阻害剤であり、中枢神経系転移に対する臨床活性も有しています。現在、タグリッソ40mg錠および80mg錠の1日1回経口投与は、EGFRm進行NSCLCの一次治療、およびEGFR T790M遺伝子変異陽性進行NSCLCの治療薬として米国、日本、中国およびEUを含む多くの国で承認されています。また、EGFRm 早期NSCLCの術後補助療法として米国およびその他数カ国で承認されており、世界各国でも承認申請に向けた議論が進行中です。タグリッソはこれまでに全世界で約215,000人の肺がん患者さんの治療に用いられています。
肺がん領域におけるアストラゼネカについて
アストラゼネカは、さまざまな病期における異なる組織型の肺がん、治療法、作用機序に対して、承認済みおよび後期臨床開発段階の新薬候補を含め、包括的なポートフォリオを有しています。アストラゼネカは既承認薬イレッサ®(ゲフィチニブ)およびタグリッソ(オシメルチニブ)の提供や、現在進行中の第Ⅲ相試験であるLAURA、NeoADAURA、FLAURA2によって得られる新たなエビデンスを通じて、疾患の遺伝的要因としてのEGFR遺伝子変異を持つ患者さんのアンメットニーズに応えることを目指しています。当社はまた、タグリッソとc-Met受容体チロシンキナーゼの選択的阻害薬であるサボリチニブ、および他の新薬候補との併用療法を評価する、現在進行中の第Ⅱ相SAVANNAH試験およびORCHARD試験を通じて、腫瘍の耐性メカニズムを解き明かそうとしています。
アストラゼネカにおけるオンコロジー領域
アストラゼネカはオンコロジー領域において歴史的に深い経験を有しており、患者さんの人生と当社の将来を変革する可能性のある新薬ポートフォリオを保有しています。2014年から2020年までの期間に7つの新薬の販売を開始し、低分子・バイオ医薬品の広範な開発パイプラインを有する当社は、肺がん、卵巣がん、乳がんおよび血液がんに焦点を当て、成長基盤としてオンコロジー治療を進展させることに尽力しています。アストラゼネカは、がん免疫治療、腫瘍ドライバー遺伝子変異と耐性メカニズム、DNA損傷修復および抗体薬物複合体、エピジェネティクスおよび細胞療法の6つの科学的基盤を強化し、個別化併用療法の開発に挑戦し続けることでがん治療のパラダイムを再定義し、将来的にはがんによる死亡をなくすことをビジョンに掲げています。
アストラゼネカについて
アストラゼネカは、サイエンス志向のグローバルなバイオ・医薬品企業であり、主にオンコロジー、循環器・腎・代謝疾患、および呼吸器・免疫疾患の3つの重点領域において、医療用医薬品の創薬、開発、製造およびマーケティング・営業活動に従事しています。当社は、100カ国以上で事業を展開しており、その革新的な医薬品は世界中で多くの患者さんに使用されています。詳細については https://www.astrazeneca.com または、ツイッター@AstraZeneca(英語のみ)をフォローしてご覧ください。
References
1. Chouaid, C, et al. Adjuvant treatment patterns and outcomes in patients with stage IB-IIIA non-small cell lung cancer in France, Germany, and the United Kingdom based on the LuCaBIS burden of illness study. Lung Cancer 2018;124:310–316.
2. Buck, P.O., et al. Treatment Patterns and Health Resource Utilization Among Patients Diagnosed With Early Stage Resected Non-Small Cell Lung Cancer at US Community Oncology Practices. Clin Lung Cancer 2015;16:486-495.
3. Trial collaboration with Daiichi Sankyo which maintains exclusive rights to patritumab deruxtecan.
4. World Health Organization. International Agency for Research on Cancer. Lung Fact Sheet. Available at https://gco.iarc.fr/today/data/factsheets/cancers/15-Lung-fact-sheet.pdf Accessed January 2021.
5. LUNGevity Foundation. Types of Lung Cancer. Available at https://lungevity.org/for-patients-caregivers/lung-cancer-101/types-of-lung-cancer Accessed January 2021.
6. Cagle P, et al. Lung Cancer Biomarkers: Present Status and Future Developments. Archives Pathology Lab Med. 2013;137:1191-1198.
7. Le Chevalier T, et al. Adjuvant Chemotherapy for Resectable Non-Small-Cell Lung Cancer: Where is it Going? Ann Oncol. 2010;21:196-8.
8. Datta D, et al. Preoperative Evaluation of Patients Undergoing Lung Resection Surgery. Chest. 2003;123: 2096–2103.
9. Sethi S, et al. Incidental Nodule Management – Should There Be a Formal Process?. Journal of Thorac Onc. 2016:8;S494-S497.
10. LUNGevity Foundation. Screening and Early Detection. Available at https://lungevity.org/for-patients-caregivers/lung-cancer-101/screening-early-detection Accessed January 2021.
11. Pignon, J.P., et al. Lung Adjuvant Cisplatin Evaluation: A Pooled Analysis by the LACE Collaborative Group. J Clin Oncol 2008;26:3552-3559.
12. Szumera-Ciećkiewicz A, et al. EGFR Mutation Testing on Cytological and Histological Samples in Non-Small Cell Lung Cancer: a Polish, Single Institution Study and Systematic Review of European Incidence. Int J Clin Exp Pathol. 2013:6;2800-12.
13. Keedy V.L., et al. American Society of Clinical Oncology Provisional Clinical Opinion: Epidermal Growth Factor Receptor (EGFR) Mutation Testing for Patients with Advanced Non-Small-Cell Lung Cancer Considering First-Line EGFR Tyrosine Kinase Inhibitor Therapy. J Clin Oncol. 2011:29;2121-27.
14. Ellison G, et al. EGFR Mutation Testing in Lung Cancer: a Review of Available Methods and Their Use for Analysis of Tumour Tissue and Cytology Samples. J Clin Pathol. 2013:66;79-89.
15. Cross DA, et al. AZD9291, an Irreversible EGFR TKI, Overcomes T790M-Mediated Resistance to EGFR Inhibitors in Lung Cancer. Cancer Discov. 2014;4(9):1046-1061.